Nature | 于杰团队揭示全脑内源NMDA受体的构象多样性与门控完全开放机制
大脑中的神经元通过突触相互连接,形成复杂的神经网络。突触传递的强度和效率持续发生变化,这一现象称为突触可塑性,被认为是学习和记忆的细胞基础。NMDA受体是一类离子型谷氨酸受体,在介导兴奋性神经传递和调控突触可塑性方面发挥着核心作用。当NMDA受体功能异常时,可能导致癫痫、精神分裂症、抑郁症和阿尔茨海默病等多种神经系统疾病。
NMDA受体是由不同亚基组成的异源四聚体,通常包含两个必需的GluN1亚基和两个GluN2亚基(GluN2A-D)或GluN3亚基(GluN3A-B)。不同亚基的组合赋予受体不同的功能特性:含GluN2A的受体激活速度快,含GluN2B的受体则激活较慢但持续时间更长。这种亚基组成的差异也影响受体对药物的反应,因此解析天然状态下受体的亚基组成、组装方式和门控转换机制,对于开发靶向特定亚型的治疗药物具有重要意义。
过去的研究主要依赖体外重组表达的NMDA受体,虽然获得了大量结构信息,但异源表达系统难以完全模拟神经元内的真实脂质环境,且通常只包含特定的亚基组合。大脑中的内源受体可能具有更复杂的组成和构象动态,因此直接从脑组织中解析其结构成为该领域的重要挑战。
2026年2月11日,中国科学院上海有机化学研究所生物与化学交叉研究中心于杰团队在Nature期刊发表了题为 “Conformational diversity and fully opening mechanism of native NMDA receptor”的研究论文。研究团队通过免疫亲和纯化,单分子全内反射荧光显微镜和冷冻电镜技术,首次从小鼠全脑组织中提取出内源NMDA受体,解析了十种不同的组装结构,完整呈现了内源受体的构象多样性,并捕获了一种新的完全开放状态。
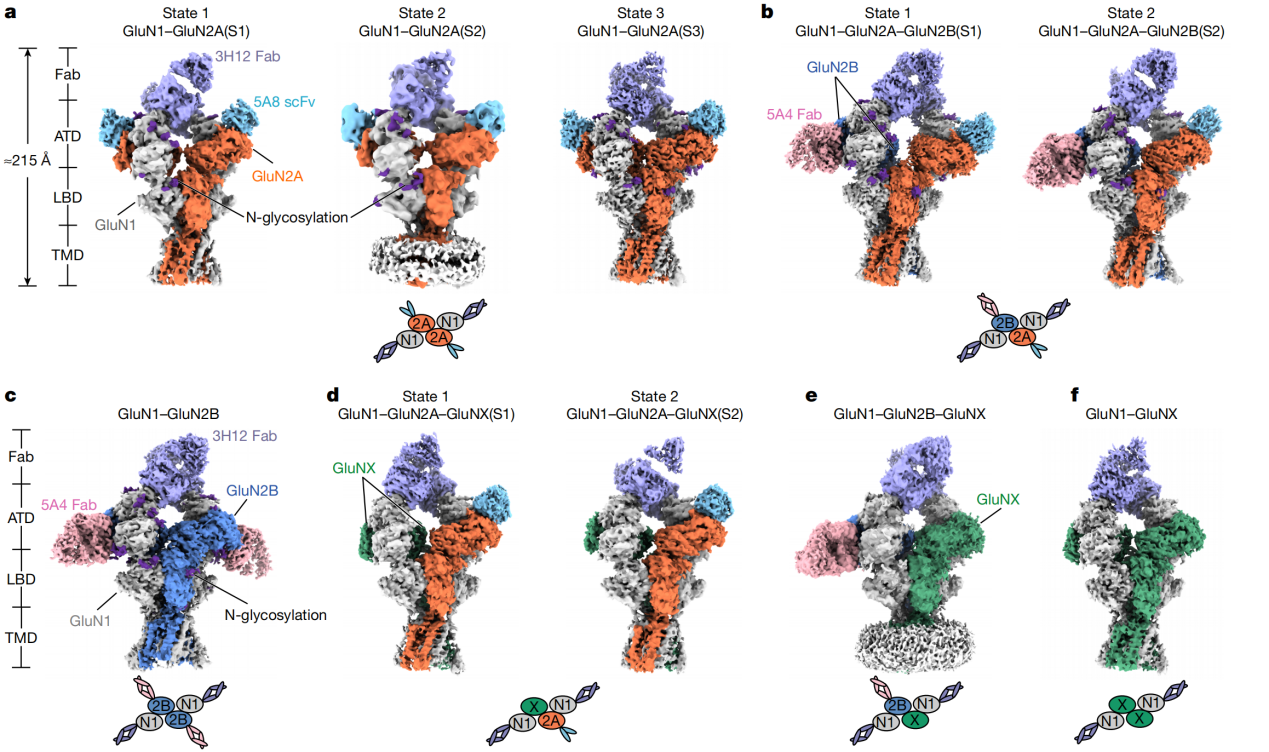
图1 内源NMDA受体的十种组装体及其亚基组成
研究发现,含GluN2A亚基的受体在全脑中占主导地位。GluN2A的氨基末端结构域(ATD)表现出显著的构象柔性,这种动态变化可能调节从ATD到LBD-TMD区域的信号传递,影响通道门控特性。结合电生理结果,研究表明,GluN2A-ATD 的高度灵活性是 GluN2A 型受体表现出快速动力学特征及其独特药理学性质的重要结构基础。
尤为重要的是,研究团队在内源性 GluN1-GluN2B 受体中捕获到一个此前从未观察到的完全开放构象。该结构显示,通道门控M3 helix在 GluN1 和 GluN2B 两个亚基中均发生明显向外旋转,导致离子通道孔径显著扩大,从而实现真正意义上的通道开放。这一发现解决了 NMDA 受体研究领域长期存在的关键问题,为理解配体结合如何驱动通道完全开启提供了直接的结构证据。
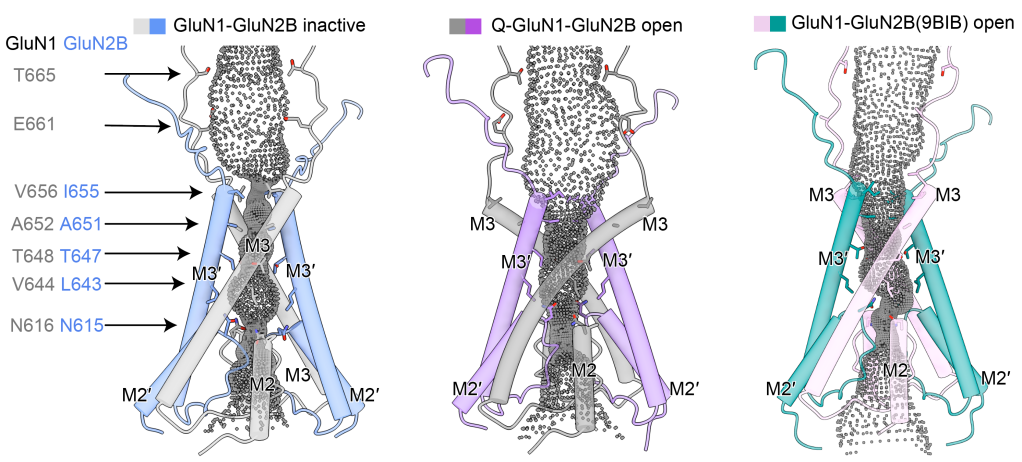
图2 内源GluN1-GluN2B受体的通道孔径分布图
(左图为非活性状态,中间为完全开放态,右图为已报道开放态)
这些发现揭示了内源性NMDA受体的构象多样性和门控机制,强调了GluN2A在突触信号传导中的核心作用,并为理解大脑中亚型特异性受体的功能建立了结构框架。
中国科学院上海有机化学研究所生物与化学交叉研究中心于杰研究员为该论文通讯作者,上海科技大学盖景鹏教授为共同通讯作者;中国科学院生物与化学交叉研究中心博士研究生徐睿声为第一作者。中国科学院生物与化学交叉研究中心陈椰林研究员、张耀阳研究员、朱正江研究员、陈忠文研究员和葛一凡副研究员在研究中提供了重要支持与帮助。本研究受到国家自然科学基金海外优青项目、中国科学院上海分院青年英才培育计划以及上海市科委的资助。
原文链接:https://www.nature.com/articles/s41586-026-10139-w
附件下载:

